Prévention
La médecine moderne tend de plus en plus vers la médecine préventive. En ce qui concerne le cancer du sein, ces dernières années ont vu un changement vers la prévention avec la découverte du gène BRCA. Entre-temps, plusieurs gènes ont été identifiés ainsi que plusieurs facteurs de risque décrits. Selon ces éléments, une stratégie de dépistage personnalisée peut être choisie. Il est donc important de comprendre ces facteurs de risque et génétiques.
Diagnostic
J'ai reçu un diagnostic de cancer ... Ce site web est un portail qui vous aidera, ainsi que vos proches, à trouver des informations personnelles et des réponses à vos problèmes.
Ce site devrait fournir des conseils et un soutien aux patients sur leur chemin vers le rétablissement et une meilleure qualité de vie.
La partie "Diagnostic" de notre site est organisée en deux sections principales. Tout d'abord, dans "Anatomie et physiologie", nous fournissons une compréhension de base du sein. Dans la deuxième partie "Tumeurs et Maladies", nous approfondirons tout ce qui concerne les affections mammaires.
De plus, nous souhaitons informer les femmes qui se demandent si elles ont un problème mammaire, mais ne souhaitent pas consulter immédiatement leur médecin à ce sujet. Les connaissances et les informations peuvent souvent offrir une réassurance immédiate si la femme est capable d'identifier elle-même le problème et de constater qu'aucun traitement spécifique n'est nécessaire. D'autre part, nous essayons également d'informer les femmes qui ont en effet reçu un diagnostic de problème mammaire grave, comme une maladie maligne, et qui souhaitent consulter leur médecin bien préparées.
Thérapie
Dans le traitement du cancer du sein, le choix de la reconstruction doit être envisagé dès le départ. Il n'y a pas de but plus fondamental pour notre Fondation que de sensibiliser les patients et les chirurgiens oncologiques à cette question. En prenant une décision éclairée à l'avance, nous ne compromettons pas la possibilité d'une reconstruction ultérieure sans pour autant perdre de vue l'aspect oncologique. Bien sûr, la survie prime et la décision du chirurgien oncologue prévaudra toujours.
La page "Comment choisir" contient toutes les informations que vous pouvez attendre lors d'une première consultation avant de faire enlever la tumeur. Cette page est très complète et votre chirurgien plasticien ne fournira que les informations pertinentes pour votre situation personnelle.
"L’ablation chirurgicale de la tumeur" raconte l'histoire de l'opération elle-même. Il s'agit de l'opération la plus importante car l'enlèvement réussi de la tumeur reste la priorité. Nous vous guidons à travers les différentes méthodes d'exérèse. Cette décision est souvent prise pour vous par une équipe multidisciplinaire composée d'oncologues, de radiologues, de pathologistes, de radiothérapeutes, d'infirmières spécialisées en oncologie, de gynécologues, de chirurgiens oncologiques et de chirurgiens plasticiens.
Dans la section "Introduction à la reconstruction mammaire", vous trouverez toutes les informations et illustrations des différentes méthodes de reconstruction avec les étapes correspondantes.
Revalidation
Les personnes traitées pour un cancer ont souvent besoin d'une longue période de récupération.
Le cancer est une maladie radicale dont le traitement est lourd. Souvent, les personnes doivent faire face à des problèmes psychosociaux et/ou physiques par la suite, tels que le stress, l'anxiété, la fatigue extrême, les articulations douloureuses, la baisse de forme, le lymphœdème... Cela peut avoir un impact important sur le bien-être général.
La plupart des hôpitaux proposent des programmes de révalidation. Nous couvrons ici quelques-uns des principaux sujets.
Quality of Life
La qualité de vie est un facteur clé pour faire face au cancer du sein. Il est donc important de trouver des mécanismes d'adaptation qui fonctionnent, et qui seront différents d'une patiente à l'autre. Pour certaines, il peut s'agir de trouver du plaisir dans les activités qu'elles pratiquaient avant le diagnostic, de prendre le temps d'apprécier la vie et d'exprimer sa gratitude, de faire du bénévolat, de faire de l'exercice physique... Des études ont montré que l'acceptation de la maladie comme faisant partie de la vie est un élément clé pour faire face efficacement à la maladie, ainsi que pour se concentrer sur la force mentale afin de permettre au patient d'avancer dans la vie. Dans cette section, nous abordons certains sujets que les patients rencontrent pendant et après le traitement et nous fournissons des informations pour y répondre.
Facteurs génétiques
Les antécédents familiaux
es antécédents familiaux lourds sont l'un des indicateurs les plus forts d'un risque accru de développer un cancer du sein. Plus le nombre de femmes ayant reçu un diagnostic de cancer du sein est élevé dans une famille, plus les liens de parenté sont étroits, et plus l'âge au moment du diagnostic est jeune, plus le risque que les autres femmes de cette famille développent elles-mêmes un cancer du sein est élevé.
Nous estimons qu'environ 20 à 30 % des patientes atteintes d'un cancer du sein ont au moins un parent atteint de la même maladie, et qu'environ 5 à 10 % des patientes ont une forte prédisposition génétique :
le nombre de parents qui ont développé un cancer du sein ou de l'ovaire dans leur famille,
le rapport entre le nombre de femmes affectées et non affectées,
le degré de parenté entre les individus affectés,
l'âge auquel le cancer du sein a été diagnostiqué chez ses proches,
l'apparition d'un cancer du sein dans les deux seins (carcinome mammaire bilatéral) chez un parent,
l'apparition du cancer de l'ovaire dans la famille, et
l'apparition du cancer du sein chez l'homme.
Ces éléments constituent le point de départ pour attribuer aux patients un risque élevé, modéré ou légèrement accru. Sur la base de ce risque, des conseils sur la politique optimale de dépistage sont donnés en premier lieu.
En plus des informations sur le risque de cancer du sein, nous utilisons également les données familiales pour identifier les familles dans lesquelles la mise en place d'un examen héréditaire peut être utile. Les critères que nous utilisons à cette fin sont présentés dans le tableau 1. Ces critères sont utilisés plutôt comme une ligne directrice : parfois, l'enquête est également lancée dans des familles qui ne répondent pas à ces critères, s'il y a des raisons spécifiques pour cela. Il peut s'agir par exemple : d'un pedigree difficile à évaluer (en raison d'une petite famille ou parce qu'il y a beaucoup de parents masculins) ou si la recherche héréditaire a des implications cliniques importantes. Une exception est également parfois faite pour les patients présentant une anxiété très élevée pour lesquels un test génétique devient presque vital.
Tableau 1. Critères d'inclusion pour les tests de génétique moléculaire des gènes BRCA1 et BRCA2, tels qu'ils sont habituellement appliqués :
familles ayant trois parents au premier degré* atteints d'un carcinome du sein et/ou de l'ovaire
familles comptant au moins deux parents au premier et/ou au second degré** atteints d'un carcinome du sein et/ou de l'ovaire diagnostiqué à un âge moyen inférieur à 50 ans.
tous les patients qui ont développé un cancer du sein et/ou de l'ovaire avant l'âge de 35 ans.
les personnes chez qui une mutation a été détectée dans la famille.
des patients masculins atteints de carcinome mammaire.
* Parents au premier degré : mère et fille, sœurs
** Parents au second degré : grand-mère et petit-enfant, tante et nièce
Formes familiales et héréditaires du cancer du sein
Les femmes présentant un risque fortement accru de cancer du sein ont généralement plusieurs membres de leur famille du premier degré ayant été touchés par un cancer du sein à un jeune âge, ou un ou plusieurs parents ayant eu un cancer du sein multifocal ou bilatéral. De plus, l'anamnèse familiale de ces femmes est souvent positive pour le carcinome ovarien (cancer de l'ovaire), et parfois même des membres masculins de la famille sont touchés par un cancer du sein. Pour ces familles, la prédisposition génétique est souvent due à l'héritage d'une anomalie génétique, également appelée mutation, affectant le gène BRCA1 ou BRCA2. Ces familles répondent généralement aux critères du carcinome ovarien ou mammaire héréditaire (tableau 2).
Tableau 2. Syndrome du carcinome ovarien et mammaire héréditaire et carcinome familial du sein. | |
1. Syndrome du carcinome ovarien et mammaire héréditaire : | 2. Carcinome familial du sein : |
| Cancer du sein chez au moins deux parents du premier ou du deuxième degré, à un jeune âge, sans que les conditions de la forme héréditaire soient remplies |
Pour les familles présentant un risque légèrement ou modérément accru de cancer du sein, le lien de parenté entre les membres atteints est moins prononcé et le diagnostic de cancer du sein est établi à un âge plus avancé. Ces familles sont généralement classées dans le groupe des carcinomes familiaux du sein (tableau 2). Pour une minorité de ces familles, une anomalie génétique des gènes BRCA1 ou BRCA2 peut également être identifiée. Certains indicateurs suggèrent que d'autres mutations génétiques pourraient également jouer un rôle dans ces familles. Il s'agit d'anomalies du génome qui ont une influence moins significative sur le risque de cancer du sein que les mutations des gènes BRCA1 ou BRCA2. Ces anomalies sont probablement beaucoup plus répandues que les mutations des gènes BRCA1 ou BRCA2 et peuvent donc avoir un impact plus important sur la population générale. De plus, il est fort probable que l'effet de ces variations soit influencé par des facteurs non génétiques. Malheureusement, il n'est pas actuellement possible de proposer une analyse génétique moléculaire de routine pour ces autres mutations du génome. Par conséquent, le risque pour les membres non atteints de ces familles doit être évalué à la lumière des informations fournies par l'analyse de l'arbre généalogique.
En pratique, il peut être difficile de distinguer entre un carcinome mammaire héréditaire et sa variante familiale. La contribution des mutations génétiques doit probablement être considérée comme un continuum. Dans le cas du carcinome mammaire familial, il s'agit principalement de mutations génétiques ayant une faible influence sur le risque de cancer du sein, tandis que la forme héréditaire implique généralement une mutation touchant un seul gène, BRCA1 ou BRCA2, avec une forte influence sur le risque de cancer du sein (voir figure 5.1). Malgré ces distinctions, un grand nombre de familles se trouvent à la frontière entre les deux catégories. Dans certains cas, il est possible de détecter une mutation des gènes BRCA1 ou BRCA2 dans ces familles.
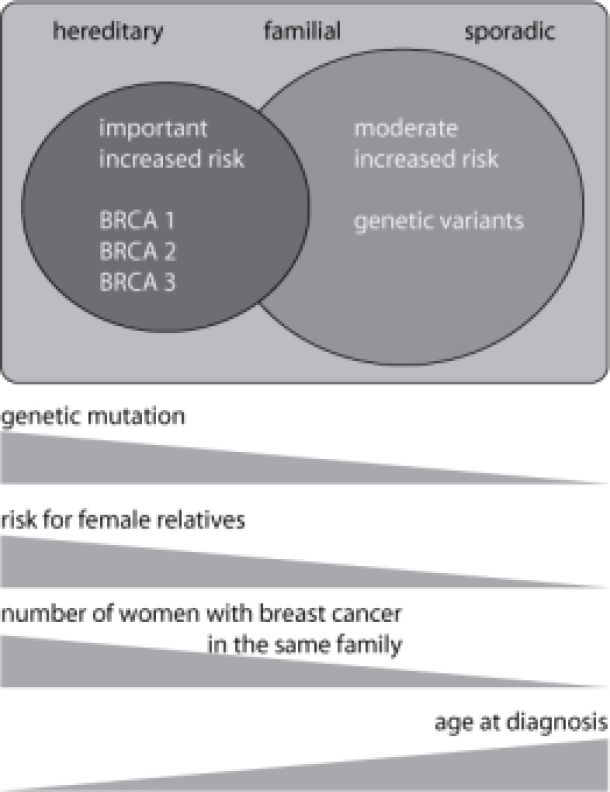
Fig. Le cancer du sein et les antécédents familiaux permettent de classer les patientes en trois groupes qui se chevauchent : les formes sporadiques, familiales et héréditaires. Les anomalies génétiques, telles que les mutations des gènes BRCA1 et BRCA2, peuvent être démontrées dans la plupart des cas de forme héréditaire. Ces mutations génétiques entraînent une forte augmentation du risque de cancer de l’ovaire et du sein chez les femmes porteuses. En ce qui concerne le carcinome familial du sein, des mutations génétiques ayant une influence moindre sur le risque de cancer du sein sont probablement en jeu. Plus la patiente est jeune lorsqu'elle reçoit son diagnostic et plus elle a de parents touchés, plus la probabilité est grande qu'il s'agisse de la forme héréditaire. Cela implique également une augmentation considérable du risque de cancer du sein pour les autres femmes de sa famille.
BRCA1, BRCA2 et hérédité du cancer de l'ovaire et du sein
Afin de mieux comprendre l’hérédité du cancer du sein, nous expliquons ici quelques principes de génétique. Notre information génétique est répartie en différents paquets appelés chromosomes. Nous possédons 46 chromosomes répartis en 23 paires : 22 paires de chromosomes appelés autosomes et une paire de chromosomes sexuels. Nous héritons d’un chromosome de chacune des paires de chromosomes de notre père, l’autre moitié des chromosomes provenant de notre mère pour reformer les 23 paires. Un chromosome est une seule longue molécule d’ADN qui contient notre code génétique. Un gène est un fragment de cet ADN, situé quelque part sur un chromosome, important sur le plan fonctionnel car il assure le codage et donc la fabrication d’une protéine qui aura un rôle spécifique. L’information contenue dans les chromosomes de chacune des paires d’autosomes est identique, donc nous possédons une copie de chaque gène. BRCA1 et BRCA2 sont en principe les gènes qui nous protègent contre le cancer. Lorsqu’un de ces deux gènes contient une faute ou une mutation, le porteur présente un risque augmenté de développer un cancer. Les anomalies génétiques des gènes BRCA1 et BRCA2 sont par ailleurs héréditaires. La probabilité qu’un porteur, homme ou femme, transmette une telle mutation à son enfant ou à ses enfants, s’élève à 50 % puisque l’erreur existera sur un des 2 chromosomes du patrimoine génétique du parent concerné.
Les femmes porteuses d’une mutation du gène BRCA1 ou BRCA2 encourent un haut risque de développer un cancer de l’ovaire ou du sein (voir tableau). Le risque de cancer du sein est probablement identique entre les porteuses d’une mutation BRCA1 ou BRCA2. La probabilité de développer un cancer du sein peut s’élever à plus de 80 %. Le risque de développer un carcinome ovarien est significativement supérieur chez les porteuses d’une mutation du gène BRCA1. Le risque est probablement également plus élevé pour les hommes porteurs de ces mutations, quoique dans une moindre mesure. En outre et contrairement aux femmes, les hommes semblent encourir un risque plus élevé de développer un cancer du sein s’ils sont porteurs d’une mutation du gène BRCA2.
Les risques particulièrement élevés liés à la mutation des gènes BRCA1 ou BRCA2 et le mode de transmission permettent de reconnaître les familles qui transmettent une telle mutation :
au diagnostic fréquent de cancer du sein à un jeune âge
à la survenue augmentée de cancer de l’ovaire et du sein dans une même famille
au diagnostic de cancer du sein bilatéral chez un ou plusieurs parents
à l’apparition de cancer du sein chez des parents masculins
Ce sont bien évidemment les mêmes critères qui servent à identifier les familles présentant un risque accru de cancer du sein.
Tableau: Risque lié à la mutation des gènes* | ||
Femmes porteuses | ||
BRCA 1 | BRCA 2 | |
Cancer du sein | 85% | 86% |
Cancer du sein controlateral** | 60% | 55% |
Cancer de l'ovaire | 63% | 27% |
Hommes porteurs | ||
BRCA 1 | BRCA 2 | |
Cancer du sein | éventuellement plus élevé | 7% |
Cancer du côlon | éventuellement plus élevé | éventuellement plus élevé |
Cancer de la prostate | 33% | 34% |
Mélanome | - | 5% |
* Le risque établi dans le tableau ci-dessus résulte d’études menées auprès des familles porteuses d’une mutation (BRCA1 ou BRCA2) causant la hausse la plus importante du risque de cancer du sein. Ces chiffres doivent donc être considérés comme des valeurs maximales.
** Apparition d’un cancer du sein dans l’autre sein, chez une femme qui a déjà développé un cancer du sein.
Les patients se demandent souvent s’ils peuvent être à l’origine de la mutation. Cependant, l’apparition d’une nouvelle mutation du gène BRCA1 ou BRCA2 est un phénomène très rare. En réalité, on observe que la mutation est transmise par un parent dans presque tous les cas. C'est pourquoi une mutation du gène BRCA1 ou BRCA2 se traduit généralement par un grand nombre de personnes atteintes de cancers de l’ovaire ou du sein au sein d'une même famille. Ce phénomène explique également pourquoi une mutation n’est presque jamais recherchée chez les patientes sans antécédents familiaux, même si le diagnostic a été établi à un jeune âge.
Les mutations des gènes BRCA1 et BRCA2 peuvent se produire tout le long du gène, sans qu'il n'existe de hotspot ou de mutation fortement récurrente. Étant donné que chacun de ces deux gènes est particulièrement grand, l'analyse génétique moléculaire prend énormément de temps et requiert beaucoup de travail : il faut environ six mois de travail par patiente.
De plus, la complexité des deux gènes influence négativement la sensibilité de l’analyse moléculaire. La sensibilité de l’analyse dépend en définitive du type de mutation apparaissant dans une population donnée. Toutes les formes de mutation ne peuvent en effet pas être détectées par la même technique. Bien que les deux gènes soient entièrement analysés au moyen de différentes techniques, il faut toujours tenir compte du fait que le résultat peut être faussement négatif : l’anomalie génétique des gènes BRCA1 ou BRCA2 peut ne pas être détectée par le type d’analyse utilisé.
Stratégies de prevention
Les femmes porteuses de mutations génétiques qui sont confrontées à un risque particulièrement élevé de cancer ont plusieurs choix en matière de mesures préventives (voir tableau).
La première option consiste à se soumettre à un dépistage intensif à intervalles réguliers. L'objectif est de détecter un cancer du sein ou de l'ovaire à un stade précoce afin de maximiser les chances de guérison.
Cependant, un dépistage intensif ne peut pas empêcher l'apparition d'un cancer. C'est pourquoi certaines femmes préfèrent subir une ablation préventive du tissu où un cancer pourrait se développer : une mastectomie préventive pour les seins et une salpingo-ovariectomie bilatérale préventive (SOB) pour les ovaires et les trompes de Fallope. Ces interventions préventives semblent efficaces pour réduire le risque de cancer de l'ovaire ou du sein, même si elles ne le réduisent pas à zéro. Un avantage majeur de la SOB préventive est qu'elle réduit également de moitié le risque de cancer du sein.
Enfin, une autre méthode de prévention est l'utilisation de médicaments pour réduire le risque de cancer, appelée chimioprophylaxie. À l'heure actuelle, il existe peu d'études sur l'efficacité de la chimioprophylaxie chez les porteuses de mutations des gènes BRCA1 ou BRCA2, ce qui rend cette option relativement controversée. Cependant, chez les femmes ayant déjà eu un cancer du sein, le tamoxifène réduit de moitié le risque de développer une nouvelle tumeur mammaire. Ainsi, la chimioprophylaxie pourrait éventuellement devenir une option pour les porteuses asymptomatiques de mutations à l'avenir.
Le choix d'une des différentes stratégies préventives est un processus complexe qui dépend à la fois de considérations médicales et personnelles. Plusieurs aspects de la vie de la patiente entrent en jeu, notamment
sa perception du risque de cancer
son désir d'avoir des enfants
sa sexualité et sa relation amoureuse
son identité de femme
les antécédents de cancer dans sa famille.
Tableau: Possibles stratégies préventives pour les porteurs et porteuses d'une mutation- des gènes BRCA1 ou BRCA2 | ||
Femmes porteuses | ||
Cancer du sein | Screening | Auto-dépistage mensuel, à partir d’un jeune âge |
Tous les trois à six mois, un examen clinique effectué par un médecin, à partir de 20 ans | ||
Échographie et mammographie annuelles, avec éventuellement une IRM, à partir de 25 ans | ||
Chirurgie préventive | Mastectomie préventive | |
Salpingo-ovariectomie bilatérale préventive | ||
Chimioprophylaxie | Tamoxifène (pour l’instant surtout chez les femmes ayant déjà souffert d’un cancer du sein) | |
Cancer de l'ovaire | Screening | Examen gynécologique tous les six mois à partir de 35 ans |
Échographie transvaginale tous les six mois à partir de 35 ans | ||
Dosage CA 125 dans le sang tous les six mois à partir de 35 ans | ||
Chirurgie préventive | Salpingo-ovariectomie bilatérale préventive | |
Chimioprophylaxie | (Éventuelle protection par contraceptifs hormonaux) | |
Hommes porteurs | ||
Cancer du sein | Screening | Pas de ligne directrice uniforme |
Cancer du côlon | Screening | Coloscopie à partir de 50 ans |
Concer de la prostate | Screening | Examen rectal de la prostate et échographie, à partir de 40 ans |
dosage PSA à partir de 40 ans | ||
Mélanome | Screening | Inspection annuelle de la peau (en principe, uniquement pour les porteurs d’une mutation du gène BRCA2) |
Le choix est compliqué par plusieurs points médicaux actuellement sujets à débat. Par exemple, l'intervalle optimal et la fréquence idéale du dépistage du cancer de l'ovaire ou du sein ne sont pas encore clairement établis. Bien que l'on espère que l'imagerie par résonance magnétique (IRM) permettra de détecter le cancer du sein à un stade plus précoce, son rôle dans le dépistage des porteuses des gènes BRCA1 et BRCA2 reste incertain. De plus, il y a un manque de données sur l'effet des différentes stratégies préventives sur l'espérance de vie. Bien qu'il soit prouvé que la chirurgie préventive peut réduire le risque de cancer, on ne sait pas encore si cette stratégie offre réellement un avantage en termes de survie par rapport à un dépistage intensif. Les effets et les risques de la substitution hormonale après une ovariectomie préventive ne sont pas clairs non plus, car il existe des préoccupations concernant une augmentation potentielle du risque de cancer du sein.
Il est évident qu'il n'y a pas de choix universellement « meilleur ». Il est essentiel de trouver une solution adaptée à chaque patiente qui lui procure un sentiment de sécurité contre le cancer tout en garantissant une qualité de vie adéquate. Pour certaines femmes, la chirurgie préventive reste la meilleure option pour réduire leur risque de cancer du sein ou de l'ovaire, tandis que d'autres préfèrent un suivi médical régulier. Le partage d'expériences avec d'autres personnes confrontées au même problème peut être utile pour prendre une décision thérapeutique éclairée.
Il est généralement recommandé aux hommes porteurs de mutations des gènes BRCA1 ou BRCA2 de suivre une stratégie de dépistage pour détecter précocement les cancers du côlon, de la prostate ou des tumeurs cutanées (tableau).
Le Gène CHEK2
En plus des mutations BRCA, d'autres mutations existent également dans des gènes qui nous protègent contre le développement du cancer. Habituellement, ces mutations ont une pénétrance plus faible, ce qui signifie que le risque de développer un cancer à cause de cette mutation est moindre. L'une des mutations les plus étudiées après les mutations BRCA est celle du gène CHEK2. Le gène CHEK2 est situé sur le chromosome 22 et est normalement responsable de la formation d'une protéine qui participe à la réparation de l'ADN endommagé. Une mutation de ce gène double donc le risque de cancer du sein. Cependant, si cette mutation se produit à la fois dans le gène hérité du père et celui de la mère, le risque de cancer du sein est multiplié par six. Cette mutation est principalement observée en Europe du Nord (Finlande, Pays-Bas), où elle affecte 3% de la population. Elle est beaucoup plus rare en Europe du Sud (0,5%).
Bien que cette mutation soit plus rare que les mutations BRCA et comporte un risque moindre de cancer du sein, elle est toujours considérée comme le troisième facteur de risque génétique le plus important pour le cancer du sein aujourd'hui.
References
Apostolou P1, Fostira F. Hereditary breast cancer: the era of new susceptibility genes.. Biomed Res Int. 2013;747318. doi: 10.1155/2013/
D. Easton. CHEK2 ∗1100delC and susceptibility to breast cancer: a collaborative analysis involving 10,860 breast cancer cases and 9,065 controls from 10 studies,” The American Journal of Human Genetics, 2004;74:1175–1182.
Liu C1, Wang Y, Wang QS, Wang YJ. The CHEK2 I157T variant and breast cancer susceptibility: a systematic review and meta-analysis.. Asian Pac J Cancer Prev. 2012;13:1355-60
S. Narod et al. Estimating survival rates after ovarian cancer among women tested for BRCA1 and BRCA2 mutations. Clinical Genetics 2012; 83:3:232–237
M. Gage, D. Wattendorf, and L. R. Henry. Translational advances regarding hereditary breast cancer syndromes. Journal of Surgical Oncology. 2012;105:5. 444–451
C. Cybulski, B. Gorski, T. Huzarski et al. Effect of CHEK2 missense variant 1157T on the risk of breast cancer in carriers of other CHEK2 or BRCA1 mutations,” Journal ofMedical Genetics 2009; 46:132–135.
Le conseil génétique concernant le cancer du sein dans la pratique
L'évaluation de l'utilité d'une analyse génétique repose en premier lieu sur l'analyse des antécédents familiaux de la patiente. Toutefois, comme expliqué précédemment, les critères du tableau 1 ne sont que des indicateurs. Les antécédents familiaux ne sont pas seulement la base sur laquelle on décide de pratiquer ou non une analyse génétique moléculaire, mais ils servent également à estimer le risque de cancer du sein pour les autres femmes de la famille, ce qui est particulièrement important lorsque l'analyse génétique ne révèle pas de mutation.
En cas de suspicion d'hérédité dans une famille, deux examens sont réalisés : l'examen génétique prédictif et l'analyse diagnostique des mutations. L'analyse diagnostique des mutations est proposée en premier lieu aux personnes ayant déjà souffert d'un cancer de l'ovaire ou du sein. Elle permet de détecter une mutation sur les gènes BRCA1 ou BRCA2. Ensuite, l'analyse génétique prédictive est proposée à toutes les parentes de la patiente, car une femme non porteuse de la mutation peut également développer un cancer de l'ovaire ou du sein sans qu'il s'agisse d'un problème héréditaire. Ce phénomène est scientifiquement appelé phénocopie.
Si l'on réalisait seulement l'analyse génétique pour cette femme, cela mènerait à une conclusion fausse pour toute la famille. Afin d'éviter cela, il est préférable de soumettre tous les membres de la famille concernés à un examen complet. L'analyse génétique effectuée chez une personne ayant déjà souffert d'un cancer est appelée analyse génétique diagnostique. Malgré les progrès récents dans les techniques, cette analyse prend environ six mois. Dans plusieurs pays européens, cette analyse est remboursée.
Si l'analyse diagnostique révèle une mutation, on peut rechercher chez tous les membres de la famille non touchés de la patiente (qui le souhaitent) s'ils ont hérité de la mutation en question. Cet examen est appelé examen pré-symptomatique ou prédictif. Il s'agit en fait d'un examen génétique diagnostique ciblé, ce qui nécessite moins de temps pour être réalisé. L'examen prédictif permet d'évaluer judicieusement le risque de cancer de l'ovaire ou du sein : les femmes non porteuses de la mutation ont le même risque que la population générale, tandis que le risque encouru par les porteuses de la mutation est considérablement augmenté. Il est également utile d'analyser les membres masculins de la famille, car leur risque de cancer du côlon ou de la prostate peut être plus élevé et ils peuvent également transmettre la mutation à leurs enfants.
Lorsque l'analyse génétique diagnostique d'une patiente ne révèle aucune mutation, il n'est pas possible de conclure quant à l'hérédité du cancer du sein dans sa famille. L'hérédité n'est pas exclue, car le résultat du test peut être faussement négatif. Il est également possible que la famille soit victime d'une mutation sur un autre gène que BRCA1 ou BRCA2. Par conséquent, le conseil génétique pour les membres de la famille de cette patiente se base sur les antécédents familiaux, car il n'est pas possible de leur proposer un examen pré-symptomatique.
Dans le cas où toutes les femmes d'une famille ayant souffert d'un cancer de l'ovaire ou du sein sont décédées, on peut envisager un examen pré-symptomatique chez une parente du premier degré qui n'a pas développé de cancer. Toutefois, ces parentes ont une chance sur deux (50%) d'être porteuses, de sorte qu'un résultat négatif doit être considéré comme non informatif. Il est possible que le gène BRCA1 ou BRCA2 des parents touchés porte la mutation, sans que la personne en question n'en ait hérité. De plus, le résultat peut également être faussement négatif. En revanche, si une mutation est découverte par cet examen génétique, on peut affirmer avec certitude que la famille est porteuse de la mutation.
Une des étapes importantes avant une analyse génétique est l'obtention du consentement éclairé de la patiente. Étant donné la nature particulière de l'analyse génétique, certains sujets doivent être abordés avec la patiente avant le début de l'analyse, afin qu'elle soit informée du processus, des implications et des résultats potentiels. Les points importants abordés sont décrits dans le tableau 4.
Tableau 4. Points importants pour l’obtention du consentement éclairé du patient avant de débuter une analyse génétique :
le droit de ne pas être examiné
l’objectif, la fiabilité et le déroulement de l’analyse génétique
le prix de l’analyse génétique
les implications d’une analyse génétique négative ou de la preuve d’une anomalie génétique
la possibilité qu’aucune information utile ne soit déduite de l’analyse
les inconvénients de l’analyse génétique
la confidentialité des résultats de l’analyse
la possibilité de discrimination
la possibilité que les enfants soient porteurs d’une mutation
En plus de fournir des informations sur l’analyse génétique, de plus en plus d’attention est portée à l’accompagnement psychologique des patients et familles qui font l’objet de l’examen, tant pour l’examen diagnostique que pour l’examen pré-symptomatique. Cet accompagnement vise principalement à offrir à la patiente et à ses proches un soutien sur mesure afin de permettre :
d’assumer les résultats du test
d’échanger les informations au sein de la famille
de choisir une stratégie préventive
de répondre aux préoccupations concernant la possibilité de port de la mutation par les enfants et les autres proches
de limiter l’impact de l’analyse génétique sur la relation et la volonté d’avoir des enfants
Une illustration
Inquiète, Elise souhaite consulter un médecin en raison des antécédents de cancer du sein dans sa famille. Elle a 27 ans et est en bonne santé, n'ayant jamais été atteinte d'un cancer du sein. Lors de la consultation, un arbre généalogique est dressé, révélant qu'un grand nombre de membres de la famille du côté paternel ont été touchés par le cancer du sein : sa tante Linda a été diagnostiquée à l'âge de 38 ans, et sa grand-mère est décédée de la maladie à l'âge de 42 ans. Les deux sœurs aînées de sa grand-mère ont également été atteintes du cancer du sein : l'aînée à l'âge de 65 ans et la plus jeune avec un cancer bilatéral, d'abord à 45 ans puis à 51 ans. Deux des cinq cousines paternelles d'Elise ont également été diagnostiquées avec un cancer du sein à un jeune âge.
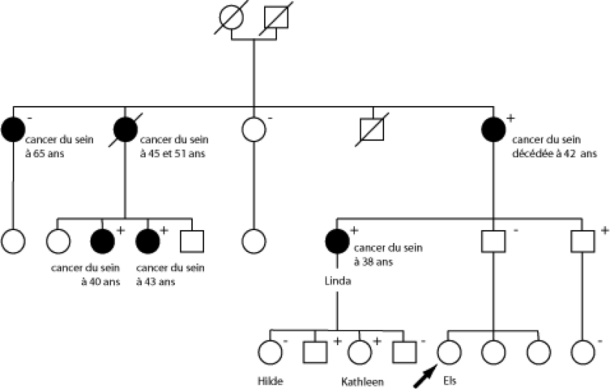
Figure:
Schéma généalogique représentatif d'une famille présentant une prédisposition héréditaire au cancer du sein. Pour des raisons d'anonymat et de confidentialité, il s'agit d'un exemple fictif basé sur l'expérience de notre pratique clinique. Les membres masculins de la famille sont représentés par des carrés, tandis que les membres féminins sont représentés par des cercles. Les femmes ayant développé un cancer du sein ou de l'ovaire sont représentées en noir. Les individus décédés sont indiqués par une barre diagonale traversant leur symbole.
Dans cette famille, de nombreux membres de différentes générations ont été atteints d'un cancer du sein à un âge précoce, suggérant une prédisposition héréditaire au cancer du sein. Pour Linda, une mutation génétique a été identifiée sur le gène BRCA1. Des tests ont révélé que d'autres membres de la famille sont également porteurs de cette mutation (indiquée par un "+"), chez des femmes ayant déjà eu un cancer du sein (analyse diagnostique) ainsi que chez des personnes non affectées (examen pré-symptomatique), tant chez les hommes que chez les femmes. Certains membres semblaient ne pas être porteurs de la mutation (indiqués par un "-"). La sœur aînée de la mère de Linda a développé un cancer du sein à l'âge de 65 ans, mais n'était pas porteuse de la mutation du gène BRCA1. Elle représente donc ce que l'on appelle une phénocopie.
Elise apprend lors de la consultation qu'il y a de fortes chances que l'hérédité joue un rôle dans l'apparition du cancer du sein dans sa famille et qu'une analyse génétique semble très utile. Elle est cependant étonnée qu'aucune prise de sang ne soit effectuée immédiatement. Le médecin lui explique que les analyses génétiques sont d'abord réalisées sur les personnes ayant déjà développé un cancer du sein, car elles sont les plus susceptibles de porter une mutation. Elise avait déjà discuté de cette analyse génétique avec sa tante Linda, qui a réagi très positivement. Elles décident donc ensemble de fixer un rendez-vous à la policlinique génétique pour que l'analyse puisse être effectuée chez Linda.
Une fois à la policlinique, Linda reçoit des informations détaillées sur le processus et la raison de l'analyse génétique, et ses motivations sont également examinées. Bien qu'elle ait envisagé de franchir le pas elle-même, c'est lorsque sa nièce Elise lui en a parlé qu'elle a pris sa décision définitive. Elle en parle également ouvertement à ses enfants. Cependant, elle s'inquiète des éventuelles conséquences d'un résultat négatif, surtout pour ses enfants, qui pourraient également avoir hérité de la prédisposition. Il ressort également de l'entretien que sa fille aînée, Hilde, vient de surmonter une dépression sévère, ce qui complique la perspective d'un examen génétique pour elle.
Avant de procéder à la prise de sang, Linda signe un formulaire déclarant avoir reçu suffisamment d'informations sur le contenu de l'analyse et les implications des résultats possibles. Bien qu'elle soit surprise que l'analyse prenne six mois, elle comprend mieux lorsque le médecin lui explique le processus d'analyse moléculaire.
Six mois plus tard, Linda reçoit une lettre lui indiquant que l'analyse est terminée et lui demandant de prendre rendez-vous pour discuter des résultats. Elle décide d'y aller avec sa nièce Elise. Comme elle s'y attendait, le médecin lui annonce qu'une mutation du gène BRCA1 a été trouvée. Linda avait déjà discuté de cette possibilité avec son oncologue et avait décidé de se faire enlever préventivement les ovaires si elle était effectivement porteuse. Bien qu'une mastectomie préventive l'effraie, elle continue à craindre de développer une nouvelle tumeur mammaire. Elle opte donc pour un suivi médical régulier de ses seins pour réduire au maximum le risque.
Elise, quant à elle, s'attend à ce qu'une prise de sang soit effectuée immédiatement pour une analyse génétique. Cependant, le médecin lui explique qu'il serait préférable d'analyser d'abord son père, car il y a une probabilité de 50% qu'il soit porteur. Si son père n'a pas hérité de la mutation, il ne sera pas nécessaire d'analyser ses enfants. Bien qu'elle soit un peu déçue, la possibilité que son père ne soit pas porteur lui apporte un certain réconfort. Elle est également soulagée que l'analyse de son père prenne beaucoup moins de temps maintenant que la mutation du gène BRCA1 a été identifiée. Environ quatre semaines plus tard, son père peut aller à la consultation pour discuter des résultats. À son grand soulagement, il s'avère qu'il n'est pas porteur. Cela signifie que ni elle ni ses sœurs n'ont hérité de la mutation du gène BRCA1. Leur risque de cancer du sein n'est donc pas plus élevé que celui des autres femmes de leur âge. Elise décide de participer au dépistage normal du cancer du sein par mammographie à partir de l'âge de 50 ans.
Hilde, la fille aînée de Linda, hésite à participer à l'analyse génétique. Elle craint de ne pas pouvoir supporter un résultat négatif et décide d'attendre. En revanche, Kathleen, la fille cadette de Linda, souhaite bénéficier de l'analyse. Elle prend rendez-vous à la policlinique où elle reçoit des explications sur les différents aspects de l'analyse et a un entretien avec un psychologue. Ils discutent des motifs de sa décision et de l'impact potentiel du résultat sur sa vie future. Kathleen déclare qu'elle envisagera une mastectomie préventive si elle est porteuse. Elle ne souhaite pas retirer ses ovaires car elle se sent encore trop jeune. Elle s'inquiète davantage du risque de cancer du sein, ayant vu de près sa mère subir une chimiothérapie, et elle veut éviter cela à tout prix. Ses futurs enfants jouent également un rôle important dans sa décision : elle veut être là pour eux et souhaite donc minimiser le risque de maladie. Environ quatre semaines plus tard, Kathleen retourne à la policlinique pour discuter des résultats. L'analyse a révélé qu'elle a hérité de la mutation de sa mère. Après une période initiale d'émotions vives, elle retrouve son courage et tire sa force de sa connaissance de la situation. Elle trouve également rassurant de savoir qu'elle peut toujours s'adresser au médecin et au psychologue de la policlinique pour obtenir des informations médicales supplémentaires ou si le résultat s'avère plus difficile à accepter que prévu.
Au cours des prochains mois, on parlera beaucoup de la possibilité d'effectuer une analyse génétique dans la famille. Certains ne souhaitent pas y participer, tandis que d'autres, hommes et femmes confondus, veulent obtenir des réponses rassurantes et prennent rendez-vous. Finalement, Hilde décide également de se faire analyser. Les résultats révèlent qu'elle n'est pas porteuse. Elle est très soulagée, mais se sent quand même un peu coupable vis-à-vis de sa sœur.
